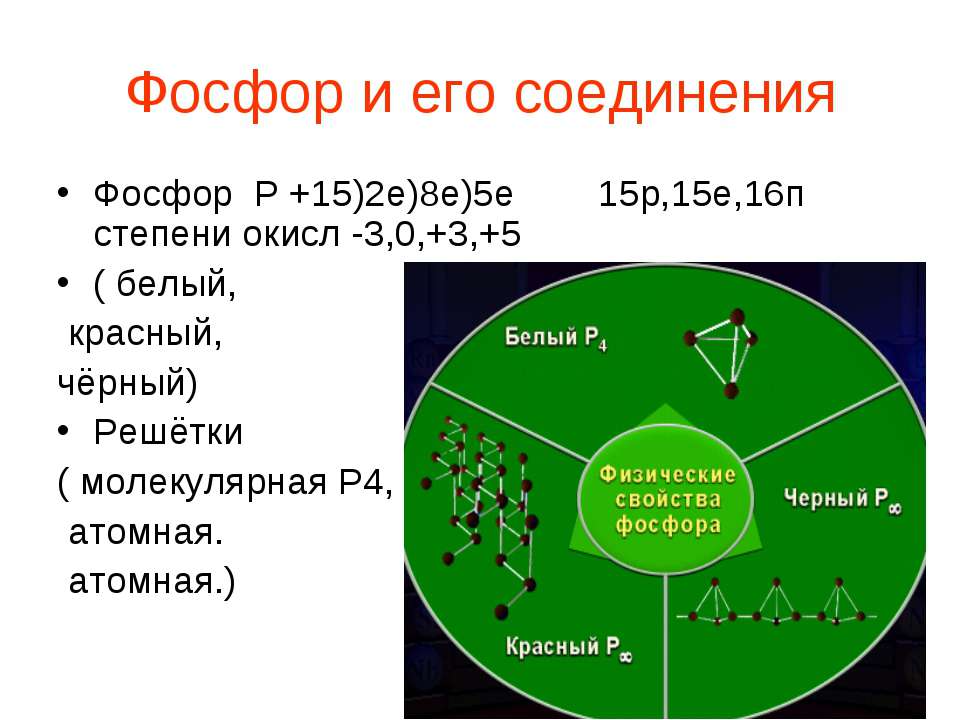
Презентация по химии "Комплексные соединения"

- Рубрика: Презентации / Другие презентации
- Просмотров: 48
Презентация для классов "Презентация по химии "Комплексные соединения"" онлайн бесплатно на сайте электронных школьных презентаций uchebniki.org.ua
Комплексные соединения
Комплексные соединения – класс соединений, в которых атомы или ионы металлов связаны с рядом анионов или нейтральных молекул.
В современной терминологии эти соединения называют – координационными соединениями.
На основе природы молекулярные соединения делятся на две категории. Они представляют собой двойные соли и комплексные соединения
Комплекс
Молекулы или оны координирующие с металлом являются лиганды
Обычно это анионы или полярные молекулы.
Теория Вернера
В 1893 г. швейцарским химиком-неоргаником Альфредом Вернером (1866–1919) была сформулирована теория, позволившая понять строение и некоторые свойства комплексных соединений и названная координационной теорией. Поэтому комплексные соединения часто называют координационными соединениями.
Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными.
Комплексообразователь – частица (атом, ион или молекула), координирующая (располагающая) вокруг себя другие ионы или молекулы.
Лиганды – частицы (молекулы и ионы), координируемые комплексообразователем и имеющие с ним непосредственно химические связи (например, ионы: Cl–, I–, NO3–, OH–; нейтральные молекулы: NH3, H2O, CO).
Центральный атом и лиганды, составляют координационную сферу
В CoCl3*6NH3 все шесть лигандов являются NH3, а 3 хлорид-иона находятся вне координационной сферы
Теория Вернера
По количеству мест, занимаемых лигандом
Монодентатные
Бидентатные
Полидентатные
[Сu(NН3)4]SО4
[CoC13(NH3)3
К4[Fе(СN)6].
Зная заряд комплексного иона и заряд каждого лиганда, можно определить степень окисления металла
Степень окисления
Зная степень окисления металла и заряды лигандов,
можно рассчитать заряд комплексного иона
Координационное число
монодентатные
полидентатные
координационное число равно
числу присоединяемых лигандов.
число лигандов меньше
значения координационного числа.
[Cu(NH3)4]SO4
1 стадия: [Cu(NH3)4]SO4 → [Cu(NH3)4]2+ + SO42−
2 стадия: [Cu(NH3)4]2+ ⇄ Cu2+ + 4NH3










![Виды комплексов по заряду<br>Катионные<br>Нейтральные<br>Анионные <br>[Сu(NН3)4]SО4<br>[CoC13(NH3)3< Виды комплексов по заряду<br>Катионные<br>Нейтральные<br>Анионные <br>[Сu(NН3)4]SО4<br>[CoC13(NH3)3<](https://Xp4sTM90BVzr.frontroute.org/s11/1/0/5/9/3/3/11.jpg)
![По количеству комплексообразователей<br>Одноядерыне<br>Многоядерные <br>K2[Be(SO4)2]<br>[CrFe(NH3)6( По количеству комплексообразователей<br>Одноядерыне<br>Многоядерные <br>K2[Be(SO4)2]<br>[CrFe(NH3)6(](https://Xp4sTM90BVzr.frontroute.org/s11/1/0/5/9/3/3/12.jpg)











![[Cu(NH3)4]SO4 <br>1 стадия: [Cu(NH3)4]SO4 → [Cu(NH3)4]2+ + SO42− <br>2 стадия: [Cu(NH3)4]2+ ⇄ Cu2+ + [Cu(NH3)4]SO4 <br>1 стадия: [Cu(NH3)4]SO4 → [Cu(NH3)4]2+ + SO42− <br>2 стадия: [Cu(NH3)4]2+ ⇄ Cu2+ +](https://Xp4sTM90BVzr.frontroute.org/s11/1/0/5/9/3/3/24.jpg)

![[Ag(NH3)2]+<br> [Ag(NH3)2]+<br>](https://Xp4sTM90BVzr.frontroute.org/s11/1/0/5/9/3/3/26.jpg)